Gründerportrait
"Wir müssen Alzheimer an der Wurzel packen!"
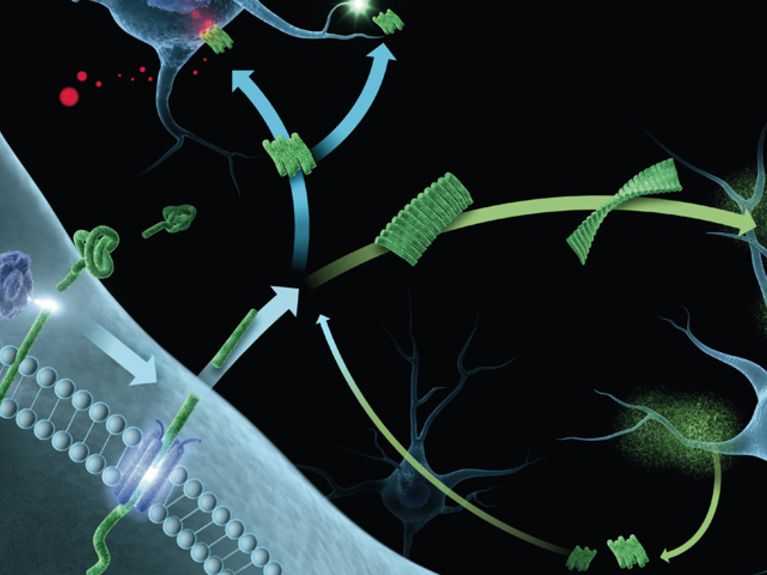
Die Bildung und Aggregation des Amyloid-beta-Proteins ist ein komplexer Prozess, den Alzheimer-Forscher erst nach und nach aufklären. Während unseres ganzen Lebens wird im Gehirn das Protein Amyloid-beta aus einem größeren Protein herausgeschnitten (links). Als einzelnes Molekül ist es harmlos, kann sich jedoch mit der Zeit zu toxischen mobilen Oligomeren zusammenlagern sowie zu unlöslichen Fibrillen und Plaques. Grafik: FZJ/illuteam43
In Deutschland sind rund 1,6 Millionen Menschen an Demenz erkrankt. Bei zwei Drittel der Betroffenen ist Alzheimer die Ursache. Jedes Jahr kommen etwa 200.000 Alzheimer-Neuerkrankungen hinzu. Die Ausgründung Priavoid arbeitet an einem Wirkstoffkandidaten zur Behandlung der Krankheit.
Schon wieder ist die Brille nicht auffindbar, das Handy verlegt und der Schlüssel steckt außen im Schloss. Alzheimer-Patienten werden immer vergesslicher, können sich schlecht orientieren und haben Schwierigkeiten beim Sprechen. Sie verlaufen sich auf dem täglichen Weg zum Bäcker, finden nicht mehr die richtigen Worte oder verlieren im Gespräch den Faden. Im Verlauf der Erkrankung nehmen die Symptome zu. Die Bewältigung des Alltags fällt ihnen zunehmend schwer und auch ihre Persönlichkeit kann sich verändern. Eine Erkrankung, die immer mehr Menschen betrifft: Rund 1,3 Millionen Alzheimer-Betroffene gibt es mittlerweile allein in Deutschland.
In Therapien und Präventionsmaßnahmen investieren
Bei der Entstehung der Alzheimer-Demenz spielt die Bildung von Eiweiß-Aggregaten im Gehirn eine zentrale Rolle. Der Übeltäter heißt Amyloid-Beta, ein Eiweiß, das natürlicherweise ständig im Körper gebildet wird und eigentlich unschädlich ist. Tun sich aber mehrere einzelne Amyloid-Beta-Moleküle (Monomere) zusammen, wird es kritisch. Sie bilden dann sogenannte Oligomere aus, die die normale Funktion der Nervenzellen im Gehirn behindern. Obendrein wird dabei eine gefährliche Kaskade in Gang gesetzt: Die Oligomere stoßen eine Reihe von synapsen- und nervenschädigenden Prozessen an, die zu den klinischen Symptomen der Alzheimer-Demenz führen. Einmal in Gang gesetzt, ist die Alzheimer-Krankheit dann nicht mehr aufzuhalten. Das will Dieter Willbold, Direktor des Instituts für Strukturbiochemie am Forschungszentrum Jülich und Mitgründer der Priavoid GmbH, ändern. "Die mit der Alterung unserer Gesellschaft einhergehende Zunahme neurodegenerativer Erkrankungen wie Alzheimer stellt ein ernstzunehmendes Problem dar", sagt Willbold. "Es ist wichtig, dass in die Erforschung und Entwicklung wirksamer Therapien und Präventionsmaßnahmen investiert wird."
Das Gründungsteam von Priavoid: Knut Adermann, Dieter Willbold, Antje Willuweit, Dagmar Jürgens, Ralph Zahn, Gunther Kauselmann (v.l.n.r.)
Den ersten wissenschaftlichen Kontakt mit Amyloid-Beta hatte Willbold in den 90er Jahren. Damals forschte er an der Universität Bayreuth als Doktorand im Bereich der Strukturbiologie. Dabei untersuchte er auch die Struktur von Amyloid-Beta. "Das Ergebnis war allerdings ernüchternd, denn Amyloid-Beta zeigte keine stabile dreidimensionale Faltung, wie sich Strukturbiologen das von Eiweißen eigentlich wünschen", sagt Willbold. "Ein hübsches 3-D-Bild konnten wir daher leider nicht erstellen." Bei diesem ersten nicht ganz zufriedenstellenden Kontakt sollte es aber nicht bleiben. Kurz nach seiner Promotion führte Willbold die Entdeckung eines neuen biotechnologischen Verfahrens, des sogenannten Spiegelbild-Phagendisplays, erneut zu Amyloid-Beta. "Auf der Publikation entdeckte ich den Namen eines Studienfreundes und rief ihn an. Und während wir telefonierten, kam mir der entscheidende Gedanke: Mit dieser Methode war es nun – bildlich gesprochen – zügig und elegant möglich, aus einer riesigen Schlüsselsammlung passende Kandidaten zum Öffnen eines verriegelten Schlosses herauszusuchen. Sie könnte das ideale Werkzeug sein, um nach Substanzen zu fahnden, die die Amyloid-Beta-Oligomere knacken können und dabei auch stabil genug für einen Einsatz zunächst im Tier und dann natürlich im Menschen sein würden", sagt Willbold. "So entstand das Forschungsprojekt, mit dem ich Ende der 90er Jahre dann als Nachwuchsgruppenleiter nach Jena an das damalige Leibniz-Institut für Molekulare Biotechnologie ging."
Moleküle optimieren und effektiver machen
Und sein Plan ging auf: Schon kurze Zeit später fand er gemeinsam mit einer Doktorandin tatsächlich ein Molekül, das in der Lage war, Amyloid-Beta-Oligomere unschädlich zu machen. "Unser nächstes Ziel war es nun, das Molekül, das wir D3 nannten, in Tiermodellen zu testen, die entwickelt wurden, um Aspekte der Alzheimer-Demenz in der Maus nachzuahmen", sagt Willbold. Seit 2001 forschte Willbold dazu an der Heinrich-Heine-Universität Düsseldorf und am Forschungszentrum Jülich. Dabei arbeitete er auch mit Kooperationspartnern weltweit, unter anderem mit zwei Kollegen in den USA. "Nachdem wir so gemeinsam zeigen konnten, dass D3 tatsächlich auch im Tiermodell wirksam ist, wollten wir das Molekül nochmals optimieren und effektiver machen." Auf der Suche nach einem möglichst effektiven Wirkstoffkandidaten entwickelte er gemeinsam mit seinem FZJ-Team ein Derivat von D3, das bei seiner Hauptfunktion, Amyloid-Beta-Oligomere zu spalten, nochmals effektiver war. Dass das PRI-002 genannte Molekül ein vielversprechender Wirkstoffkandidat sein könnte, zeigten dann auch die Ergebnisse der präklinischen Tests. "Mäuse mit Alzheimer-Symptomen, denen PRI-002 oral verabreicht wurde, verbesserten ihre kognitive Leistungsfähigkeit deutlich. Auch bei hohen Dosen gab es keine Anzeichen von Nebenwirkungen", sagt Willbold. "Im vergangenen Jahr war es dann so weit, dass wir mit PRI-002 die erste klinische Phase bei den Zulassungsbehörden beantragen konnten. Seit April 2018 wird es an gesunden Freiwilligen auf mögliche unerwünschte Nebenwirkungen geprüft."
Prionen vermeiden
Parallel zum Eingang in die klinische Phase hat ein sechsköpfiges Team um Willbold, Dagmar Jürgens und Antje Willuweit die Priavoid GmbH gegründet. Die Ausgründung aus dem Forschungszentrum Jülich und der Heinrich-Heine-Universität Düsseldorf soll die klinische Entwicklung künftig weiter vorantreiben. "Wir hoffen sehr, dass unser Wirkstoffkandidat die Hürden der klinischen Phasen nehmen wird", sagt Willbold. "Er hat einen gänzlich anderen Ansatzpunkt als bisherige Wirkstoffkandidaten, die mit unterschiedlichen Strategien versuchten, die Konzentration von Amyloid-Beta-Monomeren zu reduzieren, aber letztlich in der dritten klinischen Phase gescheitert sind – entweder wegen mangelnder Wirkung oder zu starken Nebenwirkungen." Sind bereits erste Oligomere entstanden, ist die Lawine möglicherweise schon zu stark ins Rollen gekommen, als dass eine Reduktion von Monomeren noch hilfreich wäre, vermutet Willbold. PRI-002 dagegen zerstört die krankmachenden Oligomere direkt und ohne sich auf die Unterstützung des Immunsystems verlassen zu müssen, wie dies zum Beispiel gegen Amyloid-Beta gerichtete Antikörper tun müssen, und kann so die Kaskade einer prionähnlichen Vermehrung durchbrechen. "Das ist auch der Grund, warum wir uns für den Namen Priavoid – also: Prionen vermeiden – entschieden haben. Dieser Wirkmechanismus ist aus unserer Sicht die beste Option für eine Behandlung", sagt Willbold. "Wichtig ist, dass die krankmachenden Oligomere zielgerichtet zerstört werden. Wir müssen Alzheimer an der Wurzel packen – da gibt es aus meiner Sicht keine Alternative."
Weitere Informationen:
Die Durchführung der Präklinik und der ersten klinischen Phase wird durch den Helmholtz-Validierungsfonds gefördert. Im Vorfeld der Ausgründung wurde die Priavoid GmbH zudem durch Helmholtz-Enterprise und Mittel des Innovationsfonds der Helmholtz-Zentren sowie des Technologietransferfonds des Forschungszentrum Jülich unterstützt.
Website der Ausgründung Priavoid GmbH
Heiße Spur im Fall Alzheimer (Content Viewer)
Ausgründer entwickeln Medikamente gegen Alzheimersche Krankheit (Pressemitteilung)
Leser:innenkommentare