Diabetes
So bindet Insulin an die Zelle
3-Dimensionale Darstellung des Insulinrezeptors. Bild: Jyrki Hokkanen, CSC
Forscher haben in einer Studie beobachtet, wie genau Insulin an Rezeptoren andockt. Die Ergebnisse der Grundlagenforschung könnten helfen, Krankheiten wie Diabetes besser zu verstehen.
Insulin ist ein Hormon, das den Blutzuckerspiegel regelt und in der Bauchspeicheldrüse hergestellt wird. Nach seiner Freisetzung dockt es an bestimmten Rezeptoren an, die auf der Oberfläche von Zellen zu finden sind. Diese Rezeptoren vermitteln der Zelle, dass Glukose aus dem Blut aufgenommen werden kann. Aber nicht immer funktioniert das: Wenn ein Patient die Diagnose Diabetes Typ I erhält, dann bedeutet es, dass der Körper das Hormon nicht mehr selbst produziert. Das Insulin muss von außen zugeführt werden. „Über das Insulin weiß man sehr viel, es ist ein gut erforschtes Molekül“ sagt Ünal Coskun, „aber der zweite Teil des Prozesses, also das Andocken des Insulins an die Rezeptoren und dessen Signalweitergabe, ist weitestgehend eine Blackbox.“
Coskun ist Leiter einer Forschergruppe am Paul-Langerhans-Institut des Helmholtz-Zentrums München am Universitätsklinikum Carl Gustav Carus und der Medizinischen Fakultät der TU Dresden. Zur Forschergruppe gehört auch Theresia Gutmann. Auf der Basis ihrer Forschung ist es den beiden jetzt gelungen, das Andocken des Insulins an die Rezeptoren genauer zu beobachten. Ihre Forschungsergebnisse haben sie im Journal of Cell Biology veröffentlicht. „Wir haben uns angeschaut, was genau vor sich geht, wenn Insulin an dem Rezeptor andockt“ erklärt Gutmann. „Wie wird der Rezeptor aktiviert und was muss passieren, damit in der Zelle Signalhebel angeschaltet werden?“
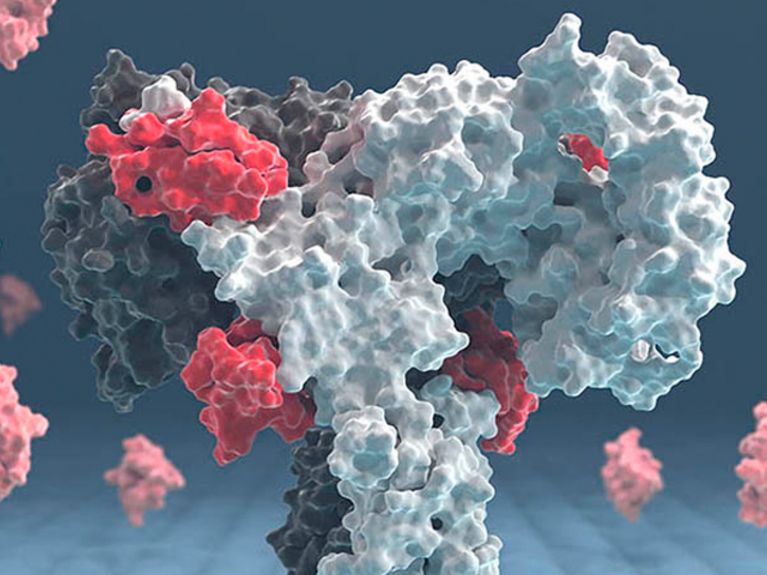
Der mit Insulinmolekülen gesättigte Insulinrezeptor. Links eine Kryoelektronenmikroskopie-Aufnahme, rechts eine schematische Darstellung des vollständigen Rezeptors. Die Ektodomäne des Insulinrezeptors ist blau und die vier Insuline sind rot gefärbt. Bild: Gutmann, Schaefer, Poojari et al.
Mithilfe von Kryoelektronenmikroskopie konnten die Wissenschaftler jetzt ein Bild des Rezeptors erstellen. In der 3D Rekonstruktion kann man zum Beispiel erkennen, wie er seine Form verändert, nachdem das Insulin angedockt hat. Mithilfe dieser Technik konnte erstmals sichtbar gemacht werden, dass das Insulin nicht nur an einer, sondern an zwei Stellen des Rezeptors anlegt.
Dieser Schritt ist spannend für Grundlagenforscher und Patienten gleichermaßen. Denn die neuen Erkenntnisse könnten die Herstellung von künstlichen Insulinen verbessern. Humanes oder Normalinsulin wird seit Jahren erfolgreich eingesetzt. Es hat aber Nachteile, was den Eintritt der Wirkung und deren Dauer betrifft, zusätzlich erfordert es bestimmte Lagerbedingungen. So hat man schon früh Veränderungen an der Struktur des Insulins, also der Zusammensetzung der Aminosäuren, vorgenommen und künstliche Insuline entwickelt, die heute zunehmend verwendet werden und gut funktionieren. Gut, das heißt: Sie senken den Blutzuckerspiegel, wobei sich das Zeitfenster der Wirkung besser regulieren lässt. So gibt es bereits schnell und lang wirksame Insuline, die je nach Bedarf genutzt werden können. Die Ergebnisse von Gutmann und Coskun könnten jetzt neue Möglichkeiten eröffnen, Krankheiten wie Diabetes „vom Rezeptor“ her zu denken. „Wir können beobachten, was passiert, wenn körpereigene und künstliche Insuline am Rezeptor andocken“ erklärt Gutmann, „und dadurch unser Verständnis des Prozesses verbessern. Dies ist die Grundlage, um bessere Insuline zu entwickeln und zu designen“.
<p>Dies ist die Grundlage, um bessere Insuline zu entwickeln</p><p></p>
Nicht nur die Passgenauigkeit des künstlichen Insulins könnte so verbessert werden – möglicherweise lassen sich auch Gefahrenquellen verhindern. Man weiß zum Beispiel, dass der Rezeptor, an dem das Insulin andockt, auch die Zellteilung begünstigen kann. „Das will man vermeiden,“ sagt Coskun, „das künstliche Insulin soll nur den Blutzucker regeln. Es soll der Zelle nicht den Befehl geben, sich zu teilen, und etwa einen Tumor zu bilden.“
„Das war ein spannendes Jahr“, sagt Gutmann. Was jetzt folgt, ist der nächste Schritt vom Labor zum Patienten. Coskun und Gutmann sind Grundlagenforscher. Sie stellen keine Insuline her, aber sie wollen, dass andere das tun. Denn die Ergebnisse zeigen, wie wichtig Grundlagenforschung für die Medizin ist. Das Netzwerk des Deutschen Zentrum für Diabetes Forschung (DZD), das vom Helmholtz Zentrum und dem Bundesministerium für Wissenschaft und Forschung ins Leben gerufen wurde, hat sich genau diese Übersetzung erfolgreicher Laborforschung in Diagnose-, Vorsorge- und Behandlungsmethoden zum Ziel gesetzt. Um diese Zusammenarbeit zu ermöglichen, haben die Forscher ihre Datenbanken für alle zugänglich ins Netz gestellt. „Jetzt brauchen wir viele Mitspieler und ein breites Netzwerk“ sagt Coskun, „Kollegen, Firmen, die Pharmaindustrie – alle müssen zusammenarbeiten, um die Ergebnisse zu nutzen.“
Cryo-EM structure of the complete and ligand-saturated insulin receptor ectodomain - Originalveröffenlichung im Journal of Cell Biology
Leser:innenkommentare