Nuklearmedizin
Fährte zum Tumor
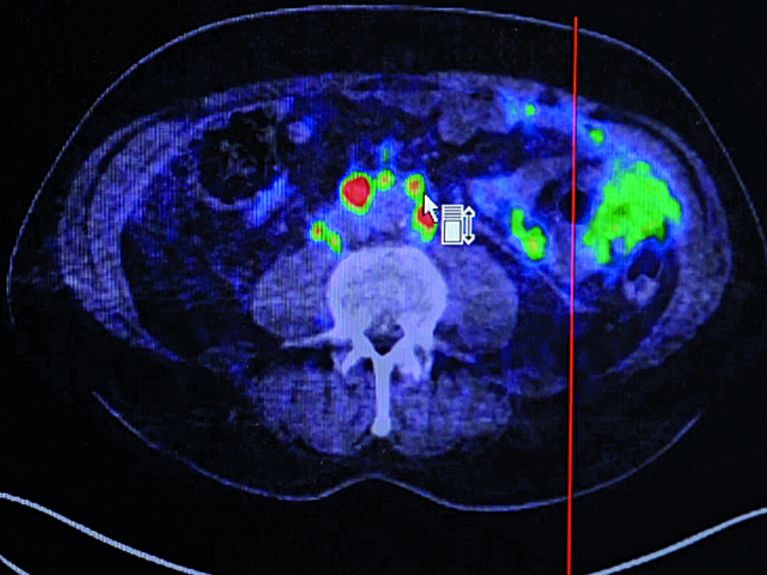
Kombinierter PET/CT-Scan zeigt Krebsmetastasen. Bild: Film zum Erwin-Schrödinger-Preis 2018 / fact+film
Die Nuklearmedizin erlebt dank spektakulärer Forschungserfolge eine Renaissance. Die größten Hoffnungen richten sich auf Methoden, mit denen Mediziner versteckte Krebsgeschwüre aufspüren und zielgenau bekämpfen können.
Sie überwuchern gesundes Gewebe, verdrängen und zerstören es. Sie sind unkontrollierbar und noch immer viel zu oft tödlich. Doch eines sind Krebsgeschwüre nicht – Fremdkörper im Patienten. Schließlich stammen die wuchernden Tumorzellen eines Krebskranken von seinen eigenen, einst gesunden Zellen ab. Ebendiese Ähnlichkeit macht es so schwer für die Medizin, eigenes von „enteignetem“ Gewebe zu unterscheiden. Der erste und oft entscheidende Schritt zur Behandlung einer Krebserkrankung ist daher, sich ein möglichst präzises Bild vom Tumor zu machen: Wo sitzt er, wo verläuft die Grenze zum gesunden Gewebe, wo im Körper haben sich womöglich Tochtergeschwulste (Metastasen) gebildet? Mit kaum einer Technik funktioniert das besser als mit dem Einsatz von sogenannten Tracern, den Spurensuchern der Nuklearmedizin. Diese kleinen, strahlenden Moleküle werden in den Körper des Patienten gespritzt und machen selbst versprengte Krebszellansammlungen sichtbar. Immer häufiger werden die Spurensucher auch in Jäger der Tumorzellen verwandelt, die den Krebs direkt vor Ort bestrahlen und abtöten. Damit haben sich der Nuklearmedizin völlig neue Möglichkeiten eröffnet: Sie kann den Krebs von innen heraus bekämpfen.
Das Prostata-spezifische Membran-Antigen (PSMA) ist auf der Oberfläche von Prostatakrebszellen zu finden und kommt im übrigen Körper kaum vor. Forscher entwickelten ein kleines Molekül, das spezifisch an PSMA bindet und mit schwach radioaktiven Substanzen – sogenannten Radionukliden – markiert ist. Es kann so selbst kleinste Krebszellherde aufspüren und sie mithilfe der sogenannten Positronen-Emissions-Tomographie (PET) sichtbar machen. Bildcollage: CLIPAREA/Custom media, Kateryna Kon, Helmholtz
Wenn von Strahlenbehandlung von Krebs die Rede ist, meinen Mediziner meistens die Bestrahlung eines Tumors von außen. Aber so erfolgreich der Ansatz auch ist: Die Strahlung kann dabei auch gesundes Gewebe schädigen, weil sie oft weite Strecken durch den Körper zurücklegen muss, bevor sie zum Krebs gelangt. Und vor allem können nur lokal begrenzte Geschwulste beschossen werden. "Wenn sich überall im Körper bereits kleine Metastasen gebildet haben, ist eine Bestrahlung von außen zwecklos und unter Umständen sogar zu gefährlich", sagt Jörg Steinbach vom Institut für Radiopharmazeutische Krebsforschung am Helmholtz-Zentrum Dresden-Rossendorf (HZDR). Tracer hingegen bringen die Strahlung direkt zu den Krebszellen und bestrahlen den Tumor von innen.
Neu ist diese Idee einer Endoradiotherapie, der „therapeutischen Tracer“, indes nicht. Schon Ende der 1930er-Jahre wurden die ersten Schilddrüsenkrebspatienten mit radioaktivem Iod-131 behandelt. Da Iod in der Schilddrüse anreichert, aus dem übrigen Körper jedoch rasch ausgeschieden wird, bleibt die Strahlung auf exakt den Ort beschränkt, wo sie wirken soll. "Das war im Grunde der Beginn der radiopharmazeutischen Theragnostik", sagt Klaus Kopka, Leiter der Abteilung Radiopharmazeutische Chemie am Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg. Denn die Strahlung verschiedener Radio-Iod-Isotope konnte sowohl für die Diagnose – die Abbildung der Erkrankung in der Schilddrüse – genutzt werden als auch als Therapeutikum zur Zerstörung der Krebszellen dienen – bis heute.
Das Molekül wird in die Tumorzelle aufgenommen und ermöglicht somit ein präzises Abbilden der Krebszellen. Bild: Kateryna Kon
Auf andere Tumorerkrankungen ließ sich dieses Prinzip allerdings lange Zeit kaum übertragen. Erst seit Biologen und Chemiker immer mehr Moleküle identifizieren, die ausschließlich oder zumindest überwiegend von Krebszellen gebildet werden, können die Spürhunde der Nuklear-
medizin auf deren Fährten gesetzt werden.
Ein besonders eindrucksvolles Beispiel dafür ist ein Protein auf der Zellmembran von Prostatakrebszellen, das "Prostata-spezifische Membranantigen" PSMA. "Es ist in allen Stadien des Prostatakarzinoms hochreguliert, das heißt, es ist auf Krebszellen viel häufiger zu finden als auf gesunden Zellen“, sagt Kopka. Sein Vorgänger Michael Eisenhut entwickelte einen „Bindungsvektor“, also ein Molekül, das an PSMA – und nur an PSMA – bindet. Zusätzlich koppelte Eisenhut diesen PSMA-11 genannten Vektor mit einem Radionuklid, wie etwa dem radioaktiv strahlenden Atom Gallium-68. Es strahlt Positronen ab, deren Strahlung in einem Positronen-Emissions-Tomographen (PET) gemessen werden kann; einem Gerät, das in großen Kliniken vorhanden ist. Weil PSMA-11 fast nur an den Tumorzellen haften bleibt, aus dem übrigen Körper aber sehr schnell entfernt wird, leuchtet nur das Prostatageschwulst im PET-Scanner auf. Und zwar so klar und deutlich, dass Ärzte den PSMA-11-Tracer seit 2011 weltweit einsetzen.
Kombinierter PET/CT-Scan zeigt in Gelb und Rot eindeutig die Anreicherungen von PSMA-Liganden und somit Krebsmetastasen. Quelle: Film zum Erwin-Schrödinger-Preis 2018/fact+film
Doch das sind noch nicht alle Vorteile dieses Tracers. "Das Besondere ist, dass PSMA-11 nach der Injektion in die Blutbahn nicht nur selektiv an die Krebszellen bindet, sondern sogar in die Tumorzellen transportiert wird", sagt Kopka. Dort bleiben die Tracer gerade so lange, um besonders scharfe Bilder vom Krebs zu liefern, bevor auch sie wieder ausgeschieden werden. „Damit werden selbst Mikrometastasen überall im Körper des Patienten sichtbar gemacht“, sagt Kopka. Eine Leistung, an der selbst beste Computer- oder Magnetresonanztomographen mitunter scheitern.
Der Gedanke, den Positronenstrahler Gallium-68 gegen ein Radionuklid auszutauschen, das Krebszellen nicht nur sichtbar macht, sondern auch zerstört, lag damit also auf der Hand. Gemeinsam entwickelten Michael Eisenhut, der Biotechnologe Matthias Eder, der Mediziner Uwe Haberkorn vom Uniklinikum Heidelberg und Klaus Kopka ein Molekül, das statt mit Gallium mit Lutetium-177 gekoppelt werden kann. Es sendet harte, zerstörerische Betastrahlung aus. Weit reicht die Strahlung dieses therapeutischen Tracers, PSMA-617 genannt, nicht – nur wenige Millimeter. So wird das umliegende gesunde Gewebe geschont, nicht aber die Tumorzellen. "Patienten, bei denen mit PSMA-11 diverse Metastasen überall im Körper entdeckt worden waren und die bestenfalls eine Lebenserwartung von wenigen Monaten hatten, konnten mit PSMA-617 in Einzelfällen bis zu zwei Jahre überleben", sagt Kopka. "Das ist sensationell."
Matthias Eder (Universitätsklinikum Freiburg, DKTK und DKFZ), Michael Eisenhut (DKFZ, emeritiert), Uwe Haberkorn (Universitätsklinikum Heidelberg und DKFZ) und Klaus Kopka (DKFZ, v.l.n.r.) erhielten auf der Helmholtz-Jahrestagung den Erwin-Schrödinger-Preis 2018. Bild: Boris Kramarić/Helmholtz
So sah das auch die Jury des Erwin-Schrödinger-Preises, der Mitte September an Eisenhut, Eder, Haberkorn und Kopka verliehen wurde. Der Wissenschaftspreis würdigt jedes Jahr innovative interdisziplinäre Leistungen in den Grenzgebieten der Medizin, Natur- und Ingenieurwissenschaften.
"Wenn man bedenkt, dass wir erst 2012/13 mit der Entwicklung von PSMA-617 begonnen haben, dann ist das eine ungewöhnlich schnelle Entwicklungszeit für ein Krebsmedikament."
Ob sich die Erfolge an vielen Patienten wiederholen und bestätigen lassen, wird derzeit von einer US-amerikanischen Firma in einer Studie an 750 Patienten mit metastasierendem Prostatakrebs überprüft. 80 Kliniken in neun Ländern sind an der Studie beteiligt, die bereits im August 2020 abgeschlossen werden soll. Dann könnte PSMA-617 für die Therapie zugelassen werden.
"Wenn man bedenkt, dass wir erst 2012/13 mit der Entwicklung von PSMA-617 begonnen haben, dann ist das eine ungewöhnlich schnelle Entwicklungszeit für ein Krebsmedikament", sagt Kopka. Für Uwe Haberkorn ist PSMA-617 indes längst ein "alter Hut". Der Mediziner arbeitet mit seinem Team bereits an einem neuen therapeutischen Tracer, der nicht nur einen bestimmten, sondern verschiedene Arten von Tumoren im Körper aufspüren und zerstören kann. Das Ziel sind bestimmte Bindegewebszellen, wie sie etwa in Bauchspeicheldrüsen-, Darm-, Lungen- und Brustkrebs vorkommen. Auf ihrer Zelloberfläche sitzt das Protein FAP, das in großen Mengen immer dann auftaucht, wenn die Krebserkrankung der Patienten weit fortgeschritten ist. Erste Versuche mit einem Tracer, der dieses Protein im Körper aufspürt, sind vielversprechend.
Mit PSMA-11 (hier mit Gallium-68-Radionuklid gekoppelt) können Metastasen des Prostatakarzinoms mittels PET sichtbar gemacht werden (A), die mit dem bis dahin verwendeten Prostatakrebs-Tracer Fluorcholin nicht entdeckt werden konnten (B). Bild: DKFZ
"Wenn das gelingt, bin ich mir sicher, dass radiopharmazeutische Behandlungen wie die PSMA-617-Therapie das Potenzial haben, Zigtausenden von Patienten zu helfen."
Systematisch suchen Radiopharmazeuten mittlerweile nach solchen krebsspezifischen Molekülen, an die sie für Diagnose und Therapie Radionuklide hängen können. Das Feld stehe erst am Anfang, meint Jörg Steinbach, der am Dresdner HZDR für ebensolche Therapieentwicklungen das Zentrum für Radiopharmazeutische Tumor-forschung gegründet hat.
Bislang beschränkt sich der Einsatz der Endoradiotherapie allerdings auf Patienten, bei denen andere Therapien nicht mehr anschlagen. "Das macht die Sache kompliziert", sagt Steinbach. "Wenn es bei einem Patienten den Verdacht auf Krebs gibt, kommen nuklearmedizinische Methoden häufig erst ganz am Schluss an die Reihe, wenn alle anderen Untersuchungen und Therapien schon durchgeführt wurden." Um sie früher einsetzen zu können, müssten die erstbehandelnden Ärzte die Methoden besser kennen. Auch die Leitlinien, in denen den Medizinern Behandlungsschritte empfohlen werden, müssten angepasst werden. "Wenn das gelingt, bin ich mir sicher, dass radiopharmazeutische Behandlungen wie die PSMA-617-Therapie das Potenzial haben, Zigtausenden von Patienten zu helfen", sagt Jörg Steinbach.
Erwin-Schrödinger-Preis
Mit dem Erwin-Schrödinger-Preis - dem Wissenschaftspreis des Stifterverbandes würdigen die Helmholtz-Gemeinschaft und der Stifterverband herausragende wissenschaftliche oder technisch innovative Leistungen, die in Grenzgebieten zwischen verschiedenen Fächern der Medizin, Natur- und Ingenieurwissenschaften erzielt worden sind und an denen Vertreter mindestens zweier Fachrichtungen mitgewirkt haben.
Leser:innenkommentare