Weltantibiotikatag
Was wirkt gegen (multi-)resistente Bakterien?
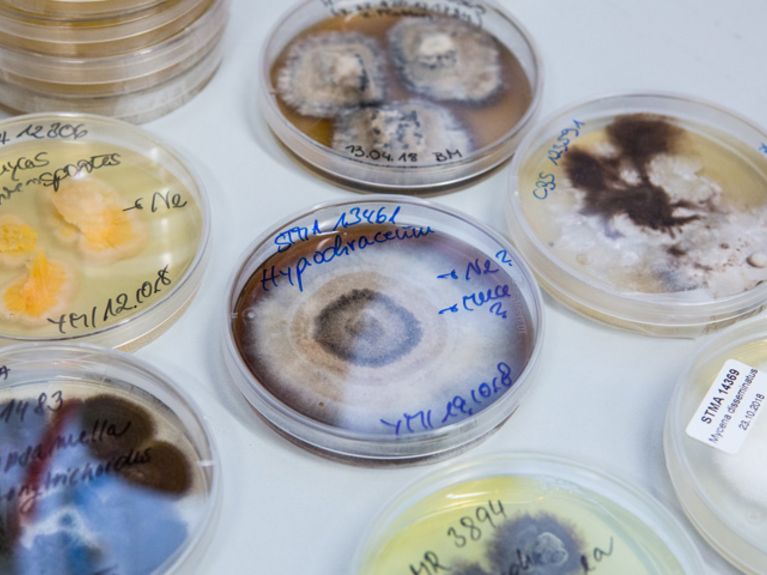
Wirkstoffe aus der Natur: Pilze sind ausgezeichnete Lieferanten antibiotischer Substanzen. Hier werden sie auf Nährboden kultiviert. Bild: Ulrike Schneeweiß
Lange Zeit galten Antibiotika als sichere Mittel gegen bakterielle Infektionskrankheiten. Doch der sorglose Umgang mit diesen Medikamenten führte zur Entstehung und Verbreitung von resistenten Bakterien. Derzeit entwickeln Forscher neue Strategien im Kampf gegen die hartnäckigen Keime.
Verantwortung der Wissenschaft: Neue Strategien entwickeln
Das Problem der Resistenzbildung wird noch verschärft durch eine Flaute bei den Zulassungen neuer Präparate. Immer mehr Pharmakonzerne ziehen sich aus der Entwicklung von Antibiotika zurück. Hohe Entwicklungskosten stehen für die Unternehmen geringen Absatzaussichten gegenüber, da neue Präparate als Reserveantibiotika vorgehalten und möglichst selten verabreicht werden sollen. “Wenn Institutionen wie unsere keine neuen Wirkstoffe entwickeln, haben wir in zehn Jahren nichts mehr gegen die Erreger in der Hand”, befürchtet Rolf Müller, Direktor am Helmholtz-Institut für Pharmazeutische Forschung Saarland (HIPS) in Saarbrücken, einem Standort des Braunschweiger Helmholtz-Zentrums für Infektionsforschung (HZI).
Prof. Dr. Eva Medina und ihr Mitarbeiter Dr. Mathias Müsken zeigen elektronenmikroskopische Aufnahmen von Bakterien in ihrem Modellsystem zur Untersuchung von Virulenzfaktoren. Bild: Ulrike Schneeweiß
In der Forschung gibt es durchaus neue Ansätze: Um Resistenzen gegen Antibiotika gar nicht erst aufkommen zu lassen, verfolgt Eva Medina, Leiterin der Infektionsimmunologie am HZI, eine neue Idee: Erreger zu entwaffnen, statt sie zu töten. Sie identifiziert mit ihren Mitarbeitern sogenannte Virulenzfaktoren der Bakterien. Das sind Eigenschaften der Erreger, die es ihm ermöglichen ihre krankmachende Wirkung zu entfalten. Dazu gehört zum Beispiel die Fähigkeit die Immunabwehr des Wirtes zu umgehen oder in Zellen einzudringen. Medinas Strategie ist es, Virulenzfaktoren zu hemmen. “Wenn wir die Virulenz der Erreger schwächen”, so Medinas Überlegung, “kann das Immunsystem leichter mit ihnen fertig werden.”
Im Gegensatz zu herkömmlichen Antibiotika fördern Inhibitoren von Virulenzfaktoren keine Resistenzen. “Wir üben weniger oder gar keinen Selektionsdruck auf den Erreger aus”, erläutert Medina. Da die Keime auch ohne funktionierenden Virulenzfaktor überleben, vermehren sich nicht selektiv diejenigen, die eventuell resistent gegen das Mittel sind. Medina sieht viel Potenzial für Antivirulenz-Medikamente. In der Praxis könnten sie Antibiotika ergänzen, die dafür kürzer und in geringeren Dosen eingesetzt werden könnten.
Der Biologin aus Spanien gefällt die Zusammenarbeit unter den Forschern am HZI. “Wir identifizieren einen Virulenzfaktor, Mark Brönstrup findet einen Inhibitor, und unsere Strukturbiologen helfen uns, den Wirkmechanismus aufzuklären”, erzählt sie begeistert. Mark Brönstrup ist Leiter der Chemischen Biologie am HZI und Koordinator der Helmholtz Wirkstoffforschung.
Interdisziplinär: Suche nach wirksamen Naturstoffen
Neue Wirkstoffe zu finden gleicht der Suche nach der Nadel im Heuhaufen. Das HZI verfügt über eine umfassende Sammlung von Naturstoffen aus Pilzen und Bakterien.
Professor Mark Brönstrup und seine Mitarbeiterin Susanne Daenicke erklären, wie das screenen großer Substanzbanken abläuft. Bild: Ulrike Schneeweiß
Die Natur bietet ein schier unendliches Portfolio an Substanzen, deren Funktion sich über Milliarden von Jahren der Evolution entwickeln konnte. Mark Brönstrup spricht daher von der “biologisch-evolutiven Voroptimierung” der HZI/HIPS-Sammlung, die etwa 800 reine, voll charakterisierte Naturstoffe neben 30 000 synthetischen Substanzen enthält. Diese durchsuchen Brönstrup und seine Mitarbeiter nach einem Wirkstoff, der den neu entdeckten Virulenzfaktor hemmt – sie “screenen” ihre Sammlung. Finden sie einen Kandidaten, versuchen die Forscher am HZI gemeinsam, die Wirkmechanismen aufzuklären und prüfen, ob sich die Substanz als Medikament eignet.
Rolf Müller und seine Mitarbeiter am Saarbrücker HIPS nutzen zusätzlich eine andere Methode des Screenens nach neuen antibiotischen Wirkstoffen. Sie durchsuchen mit Computerprogrammen die Genomsequenzen von Myxobakterien nach Genverbünden (sogenannten Genclustern), die auf Besonderheiten im Syntheseweg hinweisen. “So haben wir schon neue Kandidaten für Wirkstoffe in eigentlich bereits gut charakterisierten Stämmen gefunden.” Und wenn nötig, können die Saarbrücker Wissenschaftler so ein Gencluster in ein Bakterium verpflanzen, für das die Produktionsbedingungen bereits optimiert sind.
Rational: Designen statt suchen
Prof. Mark Brönstrup in seinem Labor, wo er mit seinen Mitarbeitern antibiotische Naturstoffe charakterisiert und optimiert. Bild: Ulrike Schneeweiß
Einen völlig anderen Weg geht Jörg Vogel, Gründer und Direktor des Helmholtz-Instituts für RNA-basierte Infektionsforschung (HIRI), dem Würzburger Standort des Mutterzentrums HZI. Ihn faszinierten die RNA-Antisense Methoden, die vor rund zwanzig Jahren aufkamen, um Genexpression gezielt zu manipulieren, ohne das Erbgut zu verändern. Sie basieren auf der Bindung eines passenden RNA-Moleküls an ein Transkript, die Abschrift eines Gens, die vorübergehend erstellt wird, wenn das im Gen programmierte Protein gerade hergestellt wird. “Das muss sich doch auch gegen Bakterien einsetzen lassen”, dachte sich Vogel. Ihn reizte der rationale Ansatz: Einen Inhibitor anhand der bekannten Gensequenz zu designen, anstatt große Substanzbanken zu durchsuchen. So konzipierte er kurze RNAs, die zu je einem spezifischen Transkript einer einzigen Bakterienart passen.
Professor Jörg Vogel vom Helmholtz-Institut für RNA-basierte Infektionsforschung. Bild: HIRI/Mario Schmitt
Damit die Bakterien die RNA-Moleküle aufnehmen, koppelt Vogel sie an Peptide, die zum Beispiel durch einen bestimmten Kanal in das Innere von Bakterien geschleust werden. “So legen wir die Spezifität des Inhibitors auf zwei Ebenen fest”, erläutert Vogel. Er hofft, durch die Kombination von einzigartiger RNA-Sequenz und einem klug gewählten Peptid sehr genau bestimmen zu können, auf welche Bakterien der Inhibitor wirkt. Und das können natürlich auch Krankheitserreger sein. Die kleinen programmierbaren Peptid-Nukleinsäuren könnten zum Beispiel eingesetzt werden, um gezielt Virulenzfaktoren auszuschalten.
So arbeiten Forscher verschiedenster Disziplinen am Helmholtz-Zentrum für Infektionsforschung Hand in Hand, um auch zukünftig wirksame Antibiotika zu entwickeln.
Leser:innenkommentare