Nanotechnologie
Per Taxi zum Tumor
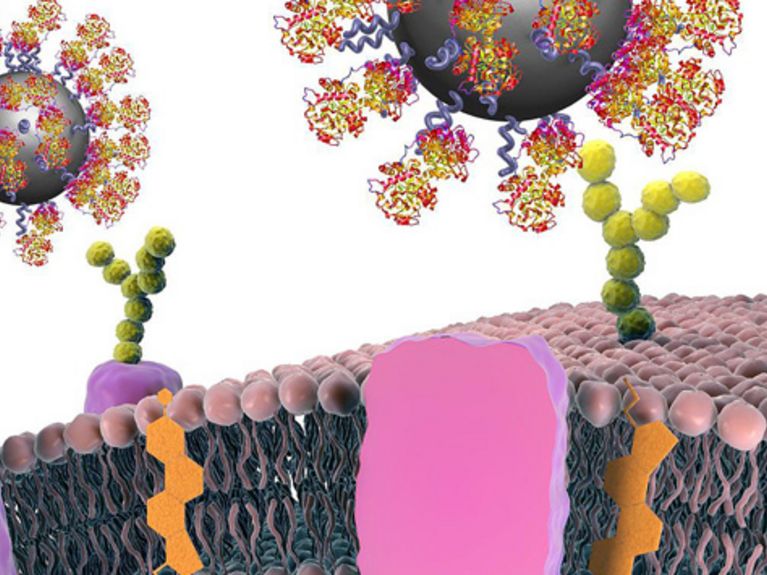
Mit Hilfe von Proteinen können Nanopartikel so funktionalisiert werden, dass sie sich spezifisch an bestimmte Krebszellen binden. Dadurch wird es möglich, Tumore aufzuspüren. Bild: CBNI, UCD
Nanopartikel bergen ein großes Potenzial für neue medizinische Behandlungsmethoden. Ihr Einsatz muss jedoch oft einige Hürden überwinden.
Ein Mensch, der durch die Innenstadt von Frankfurt am Main spaziert: So in etwa kann man sich das Größenverhältnis zwischen Nanopartikel und menschlicher Zelle vorstellen. Die Teilchen sind bis zu 100 Nanometer groß, meistens jedoch kleiner als 50 Nanometer und gelten in verschiedenen medizinischen Bereichen als Hoffnungsträger für neue Behandlungs- und Diagnostikverfahren.
Seit etwa zwanzig Jahren finden sie Einsatz in der Medizin, damals erstmalig als winzige Fähren, die ein Krebsmedikament an den Ort ihrer Bestimmung bringen. Heute werden sie noch immer am häufigsten für Krebstherapien eingesetzt, doch es gibt auch Nanosysteme für Impfungen oder die Behandlung von Pilzerkrankungen.
Nicht zuletzt ihre geringe Größe ermöglicht Nanopartikeln, in Regionen vorzudringen, die sonst nur schwer gezielt angesteuert werden können. Üblicherweise werden die Wirkstoffe in eine organische Membran eingeschlossen. Die Substanzen wandern so durch die Blutbahnen und werden im Idealfall am Ort ihrer Bestimmung freigegeben. Anstatt den Körper mit einem Medikament zu überschwemmen, kann die Dosis dadurch reduziert werden und auch noch gezielt wirken.
Solche „Drug Delivery“-Systeme sind heute die häufigste Anwendung für medizinische Nanopartikel: Von allen Unternehmen weltweit, die nanomedizinische Produkte anbieten, sind rund die Hälfte in dieser Sparte verortet. Etwa ein Viertel der übrigen Unternehmen nutzt Nanopartikel für bildgebende Verfahren und ein weiteres Fünftel arbeitet an der Herstellung prothetischer Produkte, wie zum Beispiel Material für Zahnfüllungen oder Knochenersatz.
Anders als beim Transport von Wirkstoffen gibt es jedoch auch Nanotherapien, bei denen die Partikel nicht durch den Körper aufgelöst werden. So eine Methode verwendet beispielsweise das Berliner Medizintechnik-Unternehmen MagForce. Seit 2011 bietet es in Europa eine Therapie für Hirntumore an, wie zum Beispiel das Glioblastom, eine nahezu unheilbare Krebserkrankung.
Dabei werden speziell beschichtete Eisenoxid-Partikel zunächst einmalig direkt durch die Schädeldecke in den Tumor injiziert, wo sie sich in die Zellzwischenräume begeben. Dort verbleiben sie dank ihrer besonderen Hülle für die Dauer der Therapie. Als nächstes wird der Patient in ein magnetisches Wechselfeld gebracht, das die Nanopartikel in Schwingung versetzt. Sie erzeugen dadurch Wärme, die entweder die Tumorzellen direkt abtötet oder sie empfindlicher gegenüber einer begleitenden Radio- oder Chemotherapie werden lässt.
„Unsere NanoTherm-Therapie als lokale Behandlung kann den Hirntumor in Form einer Monotherapie zerstören, wenn die Tumorgröße idealerweise fünf Kubikzentimeter oder weniger beträgt“, so Barbara von Frankenberg, Vice President Communications & Investor Relations bei MagForce. „Bei größeren Hirntumoren kann die NanoTherm-Therapie jedoch flexibel in Kombination mit Radiotherapie und/oder Chemotherapie verwendet werden, um deren Wirksamkeit zu erhöhen und somit lebensverlängernd zu wirken.“ Für die Zukunft plant das Unternehmen, auch andere Krebsformen mit der Methode behandeln zu können. In den USA läuft demnach derzeit die Zulassung einer Studie für die Behandlung von Prostatakrebs.
Auch für bildgebende Verfahren zur Diagnostik werden häufig anorganische Nanopartikel verwendet. An einer speziellen Weiterentwicklung arbeitet in diesem Bereich Holger Stephan am Helmholtz-Zentrum Dresden-Rossendorf. Er beschäftigt sich mit ultrakleinen Nanopartikeln, die lediglich ein bis drei Nanometer groß sind. Wenn man sich ein „normales“ Nanopartikel als Spaziergänger in der Frankfurter Innenstadt vorstellt, wäre ein ultrakleines Nanopartikel demnach ein kleiner Hund, der ihn begleitet.
Die Teilchen sind sie wenig größer als einzelne Moleküle und klein genug, um über die Niere ausgeschieden zu werden. Sie könnten selbst radioaktiv markiert sein und/oder Fluoreszenzlabel enthalten und so für die Bildgebung genutzt werden: Sie wandern durch die Blutbahnen an den Ort ihrer Bestimmung, zum Beispiel einem Tumor, und lagern sich dort in das Gewebe ein. Wenn von dem Körper beispielsweise mittels Computertomographie ein räumliches Bild erzeugt wird, kann das Geschwür so durch die Signal-Elemente genau lokalisiert werden.
„Es wäre aber theoretisch auch möglich, solche Partikel mit diversen Molekülen zu besetzen“, sagt der Chemiker. „So können sie nicht nur einen Wirkstoff, sondern gleich eine ganze Reihe von Diagnostikelementen und Medikamente mit sich führen.“ Derzeit arbeitet er mit seinen Kollegen unter anderem daran, radioaktiv markierte Partikel schnell genug an den Ort ihrer Bestimmung zu bringen – bevor die Moleküle zerfallen sind.
Die größte Herausforderung für die Weiterentwicklung von nanomedizinischen Methoden liefert jedoch der Körper mit zahlreichen biologischen Barrieren. Und: „Das Problem ist, dass bei jedem Einsatz von Nanopartikeln das Immunsystem erst einmal an den Stellen überlistet werden muss, wo es Fremdkörper erkennt“, sagt Stephan. „Vor allem das Lymphatische System und die Leber – sonst werden die Partikel einfach unverrichteter Dinge ausgeschieden.“ Je besser diese Aufgabe Nanomedizinern gelingt, desto mehr Türen öffnen sich für zielgenaue und vor allem schonende Therapiemöglichkeiten, nicht nur gegen Krebs, sondern auch gegen viele andere Erkrankungen.
Leser:innenkommentare