Zellbiologie
Druckventil der Zelle entschlüsselt
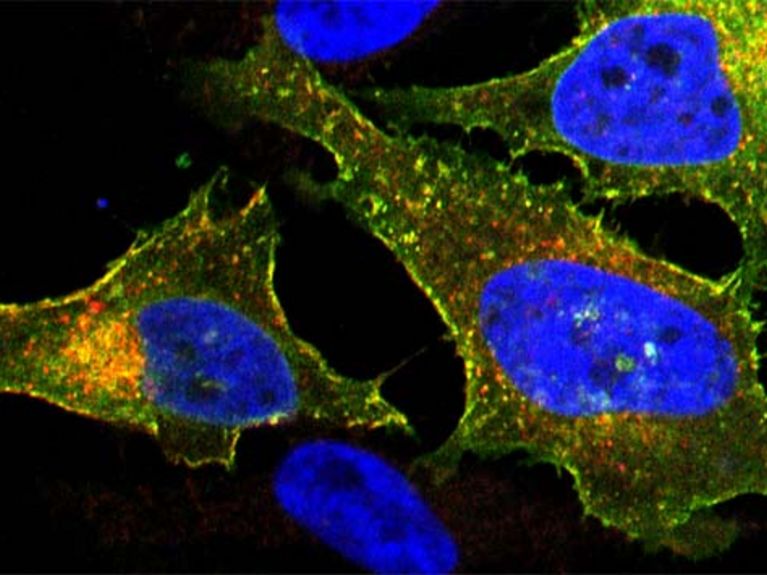
Bilden eine essentielle Komponente des volumenregulierten Anionenkanals (VRAC) in der Plasmamembran: das Protein LRRC8A (rot gefärbt) zusammen mit mindestens einem anderen der fünf Familienmitglieder (hier: LRRC8E, grün gefärbt, als Komplex vorliegend in Gelb).
Seit Jahrzehnten beißen sich Forscher die Zähne an der Frage aus, welches Protein das Druckventil in Zellen bildet. Ein Berliner Forscherteam hat nun das Geheimnis gelüftet
Damit die Zelle nicht platzt, tritt ein zelleigener Mechanismus in Kraft: Das Anschwellen aktiviert einen Kanal in der Zellmembran, den so genannten Volumen-regulierten Anionen-Kanal (VRAC). Durch ihn werden negativ geladene Ionen (Anionen), in der Hauptsache Chlorid-Ionen und organische Stoffe, aus der Zelle geschleust. Wasser strömt nach, um das Konzentrationsgefälle auszugleichen. Dadurch schrumpft die Zelle wieder auf Normalmaß. Diesen Mechanismus besitzen alle Zellen.
Wie genau dieser Prozess abläuft, konnte bisher nicht entschlüsselt werden, da die molekularen Bausteine des Kanals unbekannt waren. „Viele Konferenzen und hunderte teils hochkarätige Veröffentlichungen haben sich mit dem Kanal beschäftigt. Diejenigen Publikationen, in denen das zugrundeliegende Protein angeblich identifiziert wurde, erwiesen sich im Nachhinein als falsch “, stellt Jentsch fest. Mit den richtigen Methoden gelang den Wissenschaftlern der Durchbruch: Sie identifizierten einen wichtigen Baustein des Kanals, das Protein LRRC8A. Ihre Ergebnisse präsentierten sie im April in der Fachzeitschrift Science.
Der Chloridkanal reagiert auf ansteigenden Druck innerhalb der Zelle. Grafik: Labor Jentsch/Copyright: MDC/FMP)
Die Königsfrage war zunächst, welche molekulare Identität sich hinter dem unbekannten Protein verbirgt, das die Struktur des Anionen-Kanals maßgeblich mitbestimmt: Dazu nahmen sich die Forscher das menschliche Genom vor, das die Proteine kodiert – die berühmte Nadel im Heuhaufen der gut 22.000 menschlichen Gene. Obwohl mittlerweile jeder einzelne Baustein des Genoms entschlüsselt ist, fehlt oftmals die Zuordnung der Genprodukte, also der Proteine, zu bestimmten Funktionen. „Präzise Untersuchungen zur physiologischen Rolle und die Suche nach Interaktionspartnern war ohne die Kenntnis des zugrunde liegenden Gens natürlich unmöglich“, sagt Felizia Voss. Sie ist Doktorandin im Team von Thomas Jentsch und Erstautorin der Science-Veröffentlichung.
Ohne das ausgefeilte Methodenspektrum wäre der Erfolg nicht möglich gewesen. Dem Heuhaufen rückten die Wissenschaftler zunächst zu Leibe, indem sie einzelne Gene ausschalteten und die Konsequenzen beobachteten. Dazu nutzten sie das Hochdurchsatzverfahren der genomweiten RNA-Interferenz (RNAi), mit dem sich in relativ kurzer Zeit eine Vielzahl von Genen testen und so Rückschlüsse auf ein unbekanntes Genprodukt sowie seine Funktionen ziehen lassen. Die Methode, für die die Amerikaner Andrew Fire und Craig Mello 2006 den Nobelpreis erhielten, beruht auf einem natürlichen Prozess in der Zelle zur Abschaltung von Genen. MDC und FMP betreiben gemeinsam eine RNAi-Plattform, die von der Wissenschaftlerin Katina Lazarow betreut wird.
Nach der langwierigen Etablierung des Versuchsablaufs, arbeitete das Forscherteam durchgehend zwei Monate, sieben Tage die Woche, allein um das genomweite Screening durchzuführen. Die Wissenschaftler, zu denen auch die MDC-Bioinformatiker um Miguel Andrade-Navarro gehören, sichteten Unmengen an Datenmaterial aus dem Hochdurchsatz-Screening. „Das ist wie Fischen. Manchmal ist ein alter Schuh am Haken oder Plastikmüll. Es gab jede Menge Ausreißer unter den Ergebnissen. Aber genau unter denen hätte das mysteriöse Protein sein können“, sagt Jens Peter von Kries, Leiter der Screening Unit, zu der die Plattform gehört. In die engere Auswahl schafften es letztlich 87 Gene. Erst nachdem diese einen zweiten Scan durchlaufen hatten, waren die Forscher sicher, den entscheidenden Treffer gelandet zu haben. Der Anionen-Kanal konnte durch das Abschalten des Gens LRRC8A lahmgelegt werden – damit war ein essenzieller Bestandteil des Kanals identifiziert.
Haben das Rätsel des Kanals zu einem großen Teil gelöst: Tobias Stauber, Thomas Jentsch und Felizia Voss (von links). Bild: Maimona Id, MDC
Um dieses Ergebnis einwandfrei bestätigen zu können, stellten die Forscher mit Hilfe der CRISPR-Cas-Methode Zelllinien her, denen sowohl LRRC8A sowie einige verwandte Proteine fehlten. Das System erkennt passgenau bestimmte DNA-Abschnitte und schneidet sie an der Stelle auf – für Molekularbiologen ein ideales Werkzeug, um in einzelnen Zellen gewünschte Genabschnitte einfach zu entfernen oder einzufügen.
Damit wollten die Forscher feststellen, wie die verwandten Proteine miteinander interagieren und welche Aufgaben sie im Kanal haben. Diese Untersuchungen führten zu weiteren wichtigen Erkenntnissen. Beispielsweise entdeckten die Wissenschaftler, dass LRRC8A nur zusammen mit mindestens einem seiner Verwandten den Anionen-Kanal bildet. Dabei verändern unterschiedliche Kombinationen den Kanal. „Das erklärte endlich, warum der Kanal in verschiedenen Körpergeweben unterschiedliche Ströme auslöst“, sagt Jentsch. Obendrein klärten die Forscher weitere zellbiologische, biochemische und kinetische Eigenschaften des Kanals auf: „Wir konnten zum ersten Mal zeigen, dass auch organische Stoffe wie das körpereigene Taurin den Kanal passieren können“, sagt Tobias Stauber. Der Postdoc arbeitete gemeinsam mit Felizia Voss an der Identifikation von VRAC.
Wie genau die Öffnung des Kanals gesteuert wird, ist zwar noch nicht vollständig aufgeklärt; mit ihren Ergebnissen sind die Forscher des Rätsels Lösung jedoch einen gewaltigen Schritt näher gekommen. „Wir wissen jetzt viel mehr über den Volumen-regulierten Anionen-Kanal. Diese Informationen eröffnen uns weitere Forschungsansätze beispielsweise bei Krankheiten wie dem Schlaganfall. Hier spielt der Anionen-Kanal eine große Rolle“, betont Thomas Jentsch.
*Identification of LRRC8 Heteromers as Essential Component of the Volume-regulated Anion Channel VRAC.
Felizia K. Voss1,2,3, Florian Ullrich1,2,3, Jonas Münch1,2,3, Katina Lazarow1, Darius Lutter1,2,3, Nancy Mah2, Miguel A. Andrade-Navarro2, Jens P. von Kries1, Tobias Stauber1,2 * and Thomas J. Jentsch1,2,4 *
1Leibniz-Institut für Molekulare Pharmakologie (FMP), Berlin
2Max-Delbrück-Centrum für Molekulare Medizin (MDC), Berlin
3Graduate program of the Freie Universität Berlin
4Neurocure, Charité Universitätsmedizin, Berlin
Leser:innenkommentare