Krebsforschung
Die Wurzel allen Übels
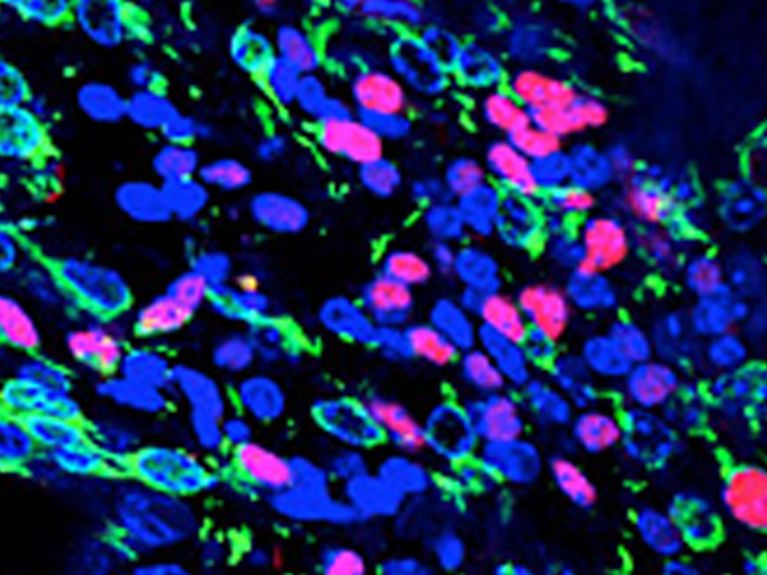
Hirntumor-Krebsstammzellen (grün) Bild: DKFZ/Hai-Kun Liu
Lange Zeit war die Existenz von Krebsstammzellen umstritten. Doch heute weiß man, dass sie die Ursache vieler Krebserkrankungen sind. Weltweit arbeiten Wissenschaftler mit Hochdruck daran, herauszufinden, wie man sie im Körper aufspüren und auslöschen kann. Denn so könnten Krebserkrankungen im Keim erstickt werden
„Wölfe im Schafspelz“ – so nennt der Helmholtz-Forscher Andreas Trumpp vom Deutschen Krebsforschungszentrum (DKFZ) in Heidelberg die Krebsstammzellen, um die in den letzten Jahren ein neues Forschungsfeld entstanden ist. Wie ihre gesunden Gegenstücke besitzen sie die Fähigkeit, sich ständig selbst zu erneuern – was sie praktisch unsterblich macht. Nach neusten Erkenntnissen sind sie nicht nur die Ursache vieler Krebserkrankungen, sondern werden auch für die Wiederkehr des Tumors nach einer vermeintlich erfolgreichen Therapie und für Metastasen mitverantwortlich gemacht. „Sie haben Eigenschaften wie normale Stammzellen, jedoch sind die zellulären und molekularen Kontrollmechanismen außer Kraft gesetzt, wodurch sie für den Organismus höchst gefährlich werden“, sagt Trumpp, der am DKFZ die Abteilung Stammzellen und Krebs leitet.
Lange Zeit war die Existenz von Krebsstammzellen umstritten, bis sie ein kanadisches Forscherteam 1997 erstmals bei Untersuchungen von Leukämie nachweisen konnten. Mittlerweile haben Forscher Krebsstammzellen in vielen weiteren Tumorarten gefunden: etwa bei Brust- und Bauchspeicheldrüsenkrebs, bei Eierstock- und Hirntumoren. Sie entstehen durch genetische Veränderungen aus normalen Gewebestammzellen oder deren direkten Nachkommen, den sogenannten Vorläuferzellen. Ähnlich wie normale Stammzellen produzieren wenige Krebsstammzellen eine riesige Anzahl von Nachkommen, die sich wiederum schnell vermehren und die eigentliche Tumormasse bilden. Allerdings verlieren die Nachkommen dabei schrittweise ihre Stammzelleigenschaften.
Bestrahlung und Chemotherapien kommen kaum gegen Krebsstammzellen an: Während die sich schnell teilenden „normalen“ Krebszellen empfindlich auf die Behandlungen reagieren und der Tumor zunächst einmal schrumpft, befinden sich Krebsstammzellen oft in einer Art vorübergehendem Tiefschlaf und überstehen so die therapeutischen Angriffe. Nach beendeter Therapie befinden sich daher oft noch einzelne Krebsstammzellen im Körper, die rasch oder aber auch erst Jahre später den Krebs wieder neu bilden können. Haben diese Krebsstammzellen in der Zwischenzeit weitere Mutationen erworben, ist der wiederaufflammende Krebs noch bösartiger als vorher und bildet in der Regel auch sehr schnell Tochtergeschwülste an anderer Stelle im Körper.
Cancer stem cells in the pancreas. Image: DKFZ/Trumpp
Andreas Trumpp ist davon überzeugt, dass eine erfolgreiche Krebstherapie nur gelingen kann, wenn nicht nur die „normalen“ Krebszellen, sondern auch die „Mutterzellen“ des Tumors gezielt vernichtet werden. Da Krebsstammzellen aber je nach Tumorart und Stadium nur einen Bruchteil des Tumors ausmachen, gleicht die Suche nach ihnen der nach der Nadel im Heuhaufen. „Wir entwickeln Methoden, mit denen wir die relativ seltenen Tumorstammzellen identifizieren können. Nur so ist es möglich diese genau zu analysieren und Therapien für eine gezielte Bekämpfung zu entwickeln“, beschreibt Trumpp das Ziel seiner Forschung. Dazu müssen er und sein Team die Biologie der Krebsstammzellen erst einmal im Detail verstehen: So suchen sie etwa nach äußeren Erkennungsmerkmalen, so genannten Biomarkern, die nur für Krebsstammzellen eines bestimmten Tumors charakteristisch sind. Außerdem möchten Trumpp und seine Kollegen herausfinden, wie sie die Zellen aus ihrem Tiefschlaf holen können: „Könnten wir diese Schläfer wecken, wäre es eventuell möglich, auch mit herkömmlichen Therapieformen Krebsstammzellen zu eliminieren und damit die Erkrankung effektiver zu behandeln.“ Die Nachschubbasis wäre zerstört. Für ruhende gesunde Blutstammzellen fanden Trumpp und seine Mitarbeiter bereits spezifische Botenstoffe, die die Zellen aus ihrem Schlaf reißen. Mit demselben Signal konnten sie auch schlafende entartete Blutkrebsstammzellen aktivieren, um sie somit empfindlich für eine anschließende Therapie zu machen.
Und noch einen Erfolg konnte das Trumpp Team kürzlich verbuchen: bei der Bekämpfung von Metastasen. Einzelne Krebszellen besitzen die Fähigkeit, sich von ihrem Haupttumor abzulösen und sich über das Blut im ganzen Körper des Patienten zu verteilen. Forscher sprechen von zirkulierenden Krebszellen. Sie sollen für die Entstehung von Metastasten verantwortlich sein. Bislang fehlten dafür aber die wissenschaftlichen Beweise. „Wir waren davon überzeugt, dass unter den zirkulierenden Krebszellen nur einige wenige in der Lage sind, neue Tochtergeschwülste in anderen Organen zu bilden“, sagt Trumpp. Schließlich entwickeln viele Patienten gar keine Metastasen, obwohl Krebszellen in ihrem Blut zirkulieren. „Es muss sich also um Krebszellen mit ganz speziellen Fähigkeiten handeln. Wir vermuteten, dass dies Metastasen-Stammzellen sind, die sich aus den Krebsstammzellen des Primärtumors ableiten.“ Tatsächlich entdeckte Trumpp zusammen mit seinen Kollegen zirkulierende Krebszellen im Blut von Brustkrebspatientinnen, die Metastasen auslösen und Eigenschaften von Krebsstammzellen aufweisen. Und auch bei der Frage, wie sich diese bekämpfen lassen, können die Heidelberger Fortschritte vorweisen: Auf der Oberfläche der zirkulierenden Metastasen-Stammzellen entdeckten sie drei charakteristische Proteine, darunter eines, das sie schon von Brustkrebsstammzellen her kannten. Je mehr von diesen Zellen mit den drei Markern im Blut nachweisbar waren, desto schlechter war die Prognose der Patientinnen. Jetzt prüfen die Forscher intensiv, ob sich diese drei Proteine als Angriffsziele im Rahmen einer Brustkrebstherapie eignen.
Auch die Mitarbeiter der DKFZ-Nachwuchsgruppe von Hai-Kun Liu erforschen Krebsstammzellen. Kürzlich entdeckten sie in Mäusen ein Schlüsselmolekül der Krebsstammzellen, die für die Entwicklung von bösartigen Hirntumoren verantwortlich sind. Schalteten sie durch einen genetischen Eingriff die Produktion dieses Proteins aus, so verloren die Krebsstammzellen ihre Fähigkeit zur Selbsterneuerung, und die krebskranken Mäuse lebten länger. Die Hirntumoren, die Liu und sein Team an Mäusen untersuchten, ähneln aggressiven Glioblastomen des Menschen. „Wir gehen davon aus, dass sich durch die Blockade des Proteins auch das Wachstum von aggressiven Hirntumoren bei Menschen eindämmen lässt“, sagt Liu. In der Kulturschale mit menschlichen Glioblastom-Stammzelllinien ist ihnen dies schon gelungen. Das Protein wäre also eine vielversprechende Zielstruktur für Therapieansätze und die Wölfe könnten damit vielleicht nicht nur enttarnt, sondern auch bekämpft werden.
Foto: DKFZ
50 Jahre Deutsches Krebsforschungszentrum – Forschen für ein Leben ohne Krebs
In diesem Jahr feiert das Deutsche Krebsforschungszentrum in Heidelberg sein 50-jähriges Bestehen. Begeben Sie sich auf eine multimediale Zeitreise durch 50 Jahre Deutsches Krebsforschungszentrum.
Leser:innenkommentare